Осознанный способ победить болезнь
По данным всемирного фонда исследования рака, в 2020 году по всему миру было зарегистрировано более 18 миллионов пациентов с онкологическими заболеваниями. При этом рак кожи и слизистой оболочки (меланома), согласно статистике, входит в топ-20 видов рака по количеству выявленных случаев.
Для лечения онкологических заболеваний сегодня применяют большое количество методов. Самые распространенные из них ― хирургия, химио- и лучевая терапия, а также гормональная терапия. Все эти методы направлены на уничтожение опухолевых клеток. Другой способ ― иммунотерапия, которая призвана перезапустить иммунитет пациента для борьбы с болезнью. В ее основе ― использование специальных противоопухолевых препаратов ингибиторов контрольных точек иммунного ответа. Они высвобождают подавленную иммунную систему пациента, чтобы Т-лимфоциты уничтожили клетки злокачественной опухоли, на которые ранее организм не реагировал.
Иммунотерапию нередко называют одним из самых перспективных методов лечения неоперабельной и метастатической меланомы. Однако результаты исследований эффективности иммунотерапии, опубликованные в научных журналах, нередко противоречивы. Одним пациентам этот метод помогает, вторым — нет, а у третьих — появляются тяжелые аутоиммунные побочные эффекты.
Кроме того, у специалистов нет доступных инструментов, которые позволяют предсказать успешность иммунотерапии и понять, что конкретно на нее влияет. По словам сотрудника международной лаборатории «Компьютерные технологии» ИТМО Артема Иванова, одно из направлений, которое может помочь решить эти вопросы, ― изучение состава микробиоты кишечника. Дело в том, что бактерии этого органа тесно связаны с иммунитетом. Например, они помогают вырабатывать антитела и лимфоциты, которые нейтрализуют вирусы и патогены
«Если пациенту не помогают иммунопрепараты, тогда ему пересаживают обработанный фекальный образец здорового донора, чтобы изменить микробиоту кишечника и стимулировать иммунитет больного. Но проблема пересадки в том, что сейчас нет критериев, по которым можно подобрать индивидуального донора для каждого пациента. Мы хотим придумать метод, который позволит сделать процедуру подбора более сознательной. Например, искать донора с нужным составом микробиоты или вручную создавать пробиотики, содержащие полезные бактерии», — объясняет Артем Иванов.
Относительное изменение представленности бактерий у пациентов с положительным и отрицательным ответом на иммунотерапию. (Согласующиеся между исследованиями виды обозначены цветом и звездами). Источник: иллюстрация из статьи в mSystems / journals.asm.org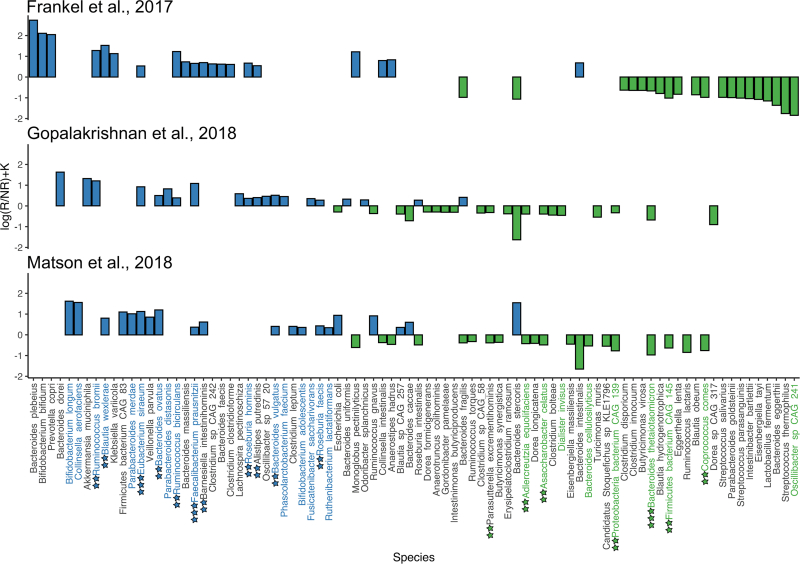
Найти нужную «иголку-бактерию» в «стоге сена» микробиоты
Чтобы разработать такой метод, сотрудники международной лаборатории «Компьютерные технологии» ИТМО совместно с коллегами из Федерального научно-клинического центра физико-химической медицины ФМБА России провели масштабное исследование. Его целью было выявить, какие биомаркеры в организме пациента свидетельствуют о том, что иммунотерапия меланомы ему подойдет и его здоровье улучшится, и какие бактерии в микробиоте кишечника влияют на успешность лечения.
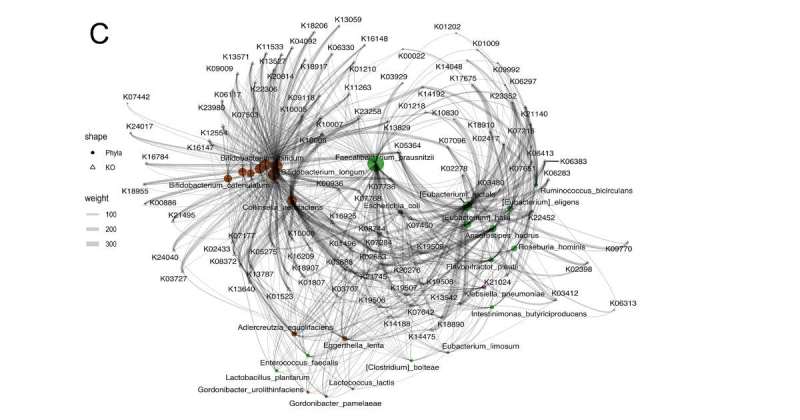
В ходе исследования ученые ИТМО собрали 680 метагеномных образцов микробиоты кишечника пациентов с онкологическими заболеваниями и разным ответом на иммунотерапию. Все данные были взяты из семи исследований, опубликованных в открытой базе данных Национального центра биотехнологической информации. Затем ученые выделили из всего набора данных три группы — метагеномные данные пациентов, которых лечили иммунопрепаратами, метагеномные данные пациентов до и после пересадки фекальных образцов ― и сравнили между собой всю информацию. Для исследования ученые использовали собственные разработки — алгоритмы MetaCherchant и RECAST, а также алгоритм анализа композиционных данных Songbird. Первый инструмент определяет связь бактерий с генами интереса (генами, которые находятся в конкретных бактериях), а второй — анализирует метагеномные данные кишечника пациента до и после пересадки микробиоты.
В результате ученым удалось выделить 101 функциональный биомаркер среди разных видов бактерий, которые определенно указывают, что иммунотерапия ингибиторами контрольных точек иммунного ответа подойдет пациенту. На основе этого вывода можно разработать диагностический тест, который заранее позволит предсказать, поможет ли пациенту иммунотерапия или нет.
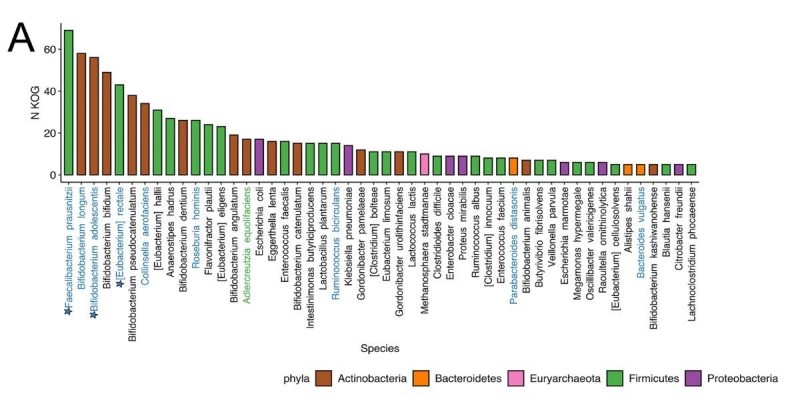
Также в составе микробиоты кишечника пациентов удалось обнаружить три вида бактерий — Faecalibacterium prausnitzii, Bifidobacterium adolescentis и Eubacterium rectale. Как отмечают авторы исследования, такой результат можно использовать, чтобы в дальнейшем составить индивидуальные рекомендации по коррекции микробиома кишечника для успешной иммунотерапии меланомы. Например, если врачи обнаружат, что у пациента не хватает некоторых бактерий, полезных для иммунотерапии, они могут быть добавлены в состав микробиоты кишечника пациента.
«То, что мы наблюдаем одну и ту же бактерию в семи исследованиях, — это большая редкость. Если можно было найти всего одну бактерию и по ней определить, есть ли у человека болезнь или нет, это было бы слишком просто. Наш кишечник устроен гораздо сложнее, и чаще всего мы ищем комбинации бактерий и биомаркеров. Например, бактерия сама по себе может ничего не значить, но при этом она может вырабатывать вещество, которое будет поглощать другая полезная бактерия. В этом смысле микробиота похожа на запутанный стог сена, и мы разрабатываем алгоритмы, которые эффективнее всего смогут найти иголку-бактерию», — объясняет Артем Иванов.
Прочитайте также:
Анализ метагенома позволяет понять роль кишечных микробов в болезни Крона
Эффективные алгоритмы для анализа микробиоты
Чтобы проверить открытие ученых ИТМО на практике, сотрудники Федерального научно-клинического центра физико-химической медицины ФМБА России проведут несколько исследований. В том числе — эксперименты на мышах. Сначала в их организме вырастят меланому, а затем с помощью трех найденных бактерий попробуют ее вылечить. Если результаты разных тестирований будут положительными, в перспективе ученые смогут создать специальные пищеварительные волокна или пробиотики. Они скорректируют состав микробиоты кишечника и тем самым потенциально смогут повысить шансы пациента на успешную иммунотерапию.
Авторы работы планируют сделать свою библиотеку разработок открытой, чтобы другие исследователи также смогли находить и детально анализировать биомаркеры метагеномов, которые игнорируют или отвечают на иммунотерапию. По словам Артема Иванова, методы, которые применялись в этом исследовании, можно использовать и для предсказания ответа на лечение при других видах злокачественных опухолей, например при немелкоклеточном раке легкого и раке шейки матки. Но глобальная цель ученых ИТМО — разработать вычислительные методы, которые позволят проводить разные исследования, связанные с микробиотой кишечника человека.
«Существуют несколько воспалительных заболеваний кишечника, которые трудно диагностировать, — например, хроническая болезнь Крона и язвенный колит. Сейчас мы проводим эксперименты на открытых данных, чтобы в дальнейшем можно было проанализировать микробиоту и предсказать, здоров ли человек или у него есть какая-либо из этих болезней. Такой анализ позволит точнее назначать лечение. Также есть исследования, которые показывают связь микробиоты с нейродегенеративными заболеваниями, в частности с болезнью Альцгеймера, поэтому мы можем развивать свои методы и в этом направлении», — отмечает Артем Иванов.
Проект поддержан грантом РНФ, а также программой Минобрнауки РФ «Приоритет-2030».
Статья: Evgenii Olekhnovich, Artem Ivanov, Anna Babkina, Arseniy Sokolov, Vladimir Ulyantsev, Dmitry Fedorov, Elena Ilina. Consistent Stool Metagenomic Biomarkers Associated with the Response To Melanoma Immunotherapy (mSystems, 2023).