Рак — одна из ведущих причин смертности в мире. В 2020 году он унес жизни почти 10 млн человек. Для диагностики и лечения онкологических заболеваний используют разные методы, в том числе МРТ и гипертермию ― вид терапии, при которой опухоли нагревают до 41–45°С, а затем проводят лучевую, химио- или радиотерапию. Гипертермия помогает повысить эффективность последних методов.
Как для МРТ-диагностики, так и при гипертермии врачи могут использовать магнитные наночастицы. В первом случае частицы выступают в качестве контрастного агента ― то есть помогают визуализировать мягкие ткани на МРТ и обнаружить опухоль.
При лечении методом гипертермии наночастицы непосредственно помогают разрушать раковые клетки. Их вводят в организм пациента, и они достигают раковых клеток, у которых нарушена проницаемость мембраны из-за патологических процессов. Под действием внешнего поля наночастицы выделяют тепловую энергию, которая разрушает опухоль. Недавно исследователи из ИТМО предложили универсальную магнитную частицу из феррита цинка и феррита марганца, которая может выступать агентом как для диагностики, так и для терапии рака.
При этом создавать наночастицы, которые бы эффективно диагностировали и лечили рак, непросто. Для этого нужно учитывать разные параметры: размер, форму, состав, покрытие и многое другое. Сейчас, чтобы найти подходящие частицы, ученым приходится подбирать и экспериментально проверять их вручную. Это довольно долго ― синтез одной частицы занимает около 4–6 часов.
Чтобы ускорить процесс, химики стараются систематизировать информацию о частицах. В частности, в обзорных статьях ученые сравнивают эффективность ранее синтезированных наноматериалов с разными параметрами частиц. Однако закономерности, которые находят ученые, довольно сложные: эффективность наночастиц зависит от многих параметров. Поэтому исследователям трудно вывести общую формулу, которая бы описывала связь между характеристиками и эффективностью наночастиц.
Другой способ решить подобные задачи в химии и материаловедении — использовать методы искусственного интеллекта. Например, с его помощью химики уже предсказывают свойства молекул и наноматериалов для систем доставки лекарств, автоматизируют эксперименты, синтезируют химические соединения с заданными характеристиками. При этом создавать наночастицы для МРТ-диагностики и гипертермии с помощью методов машинного обучения исследователи раньше не пробовали.
Прочитайте также:
На хакатоне в ИТМО разработали модели, которые помогут быстрее и дешевле создавать новые лекарства
Что придумали в ИТМО
Ученые ИТМО впервые предложили использовать алгоритмы машинного обучения, чтобы предсказывать эффективность магнитных наночастиц для МРТ и гипертермии. На вход алгоритм получает параметры наночастицы, а на выходе — описывает эффективность материала для диагностики и лечения рака. Разработанная модель помогает химикам-синтетикам быстро понимать, с какими параметрами лучше синтезировать наночастицу, чтобы получить материал с высокой эффективностью. Система способна предсказать эффективность частицы за несколько секунд.
В качестве входных данных алгоритм получает информацию о размере, форме, поверхности, элементном составе наночастиц и параметрах приложенного электромагнитного поля (рис. А). Дополнительно, используя входные данные, алгоритм рассчитывает новые параметры частицы, которые делают предсказание более точным (рис. В). На выходе модель предсказывает две основные характеристики наночастицы: значение r1/r2-релаксаций контрастного вещества (описывает эффективность МРТ-диагностики) и SAR — удельную скорость поглощения энергии (описывает эффективность гипертермии). Изображение предоставлено авторами статьи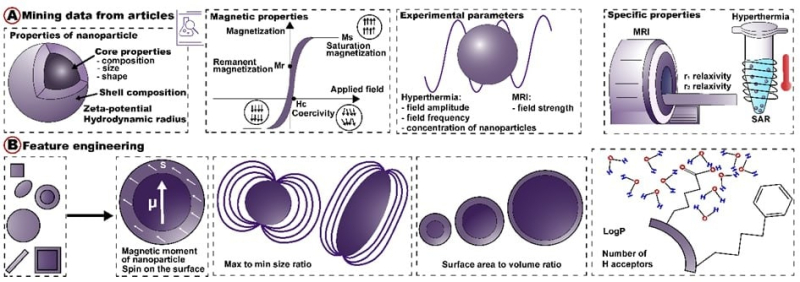
Алгоритм обучали на данных об экспериментах in vitro из открытых источников. Данные содержат информацию о свойствах и эффективности более чем 980 магнитных наночастиц. Исследователи использовали ансамблевые модели, построенные на деревьях принятия решений: LGBM Regressor и ExtraTrees Regressor.
Затем ученые протестировали модель на не использованных во время обучения тестовых образцах наночастиц и использовали метрику RMSE — она показывает, насколько предсказанные алгоритмом значения отличаются от истинных. Соответственно, чем меньше ее значение, тем лучше работает алгоритм. Для предсказания значения SAR эта метрика равнялась 0,26, для предсказания r1-релаксации — 0,27, а для r2-релаксации — 0,22. Такая разница считается минимальной и говорит о высокой точности алгоритма.
Результат работы алгоритмов. (А): Три графика, каждый из которых описывает точность предсказания значений эффективности. (В): Интерпретация построенных моделей машинного обучения с помощью SHAP-значений (описывают, как предсказываемое значение зависит от параметров системы). Изображение предоставлено авторами статьи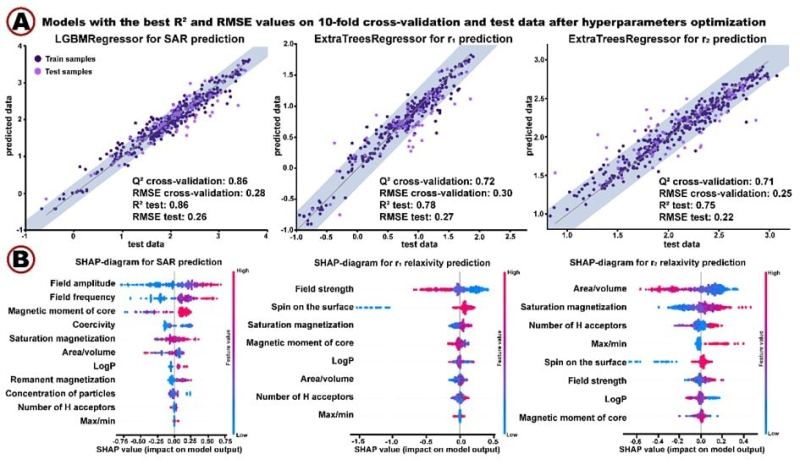
Что дальше
На основе алгоритма ученые разработали онлайн-ресурс с открытым доступом, который позволяет исследователям понять, наночастицу с какими параметрами нужно синтезировать, чтобы получить определенную эффективность. Сервис получил название DiMag, пользоваться им можно уже сейчас. С его помощью пользователи могут визуализировать зависимости между параметрами наночастиц. Также ресурс позволяет загружать свои данные об экспериментах с наночастицами.
«Сейчас наш алгоритм обучен на данных об экспериментах в пробирке — это первый этап подбора частиц с высокой эффективностью для диагностики и лечения рака с помощью МРТ и гипертермии. В будущем мы планируем обучить наш алгоритм на данных об экспериментах in vivo. Это позволит тестировать препараты на основе синтезированных наночастиц на живых организмах и в дальнейшем внедрять их в медицинскую практику», — рассказал один из авторов статьи, магистрант химико-биологического кластера ИТМО Павел Ким.
Исследование поддержано программой «Приоритет-2030».
Статья: Pavel Kim, Nikita Serov, Aleksandra Falchevskaya, Ilia Shabalkin, Andrei Dmitrenko, Daniil Kladko, Vladimir Vinogradov. Quantifying the Efficacy of Magnetic Nanoparticles for MRI and Hyperthermia Applications via Machine Learning Methods (Small, 2023)
Исследование поддержано Российским научным фондом и программой «Приоритет-2030».