Вы опубликовали обзорную статью. Каковы ее основные положения?
Статья посвящена регуляции иммунного ответа при вирусной пневмонии. Основной причиной послужила текущая ухудшающаяся ситуация с коронавирусной инфекцией, осложняющаяся присутствием других респираторных инфекций, сезонных эпидемий гриппа и так далее. В связи с этим необходимо усилить наше понимание механизмов иммунного ответа, стоящих в первую очередь за патологией дыхательной системы при подобных заболеваниях.
В чем специфичность именно вирусной пневмонии по сравнению с другими видами пневмонии?
В основном пневмония может быть вирусной или бактериальной природы. Наибольшую степень риска представляют именно вирусные пневмонии, поскольку для них характерно развитие сильного цитокинового шторма и дальнейшее повреждение легочной ткани. Вирусная пневмония также часто осложняется бактериальной инфекцией.
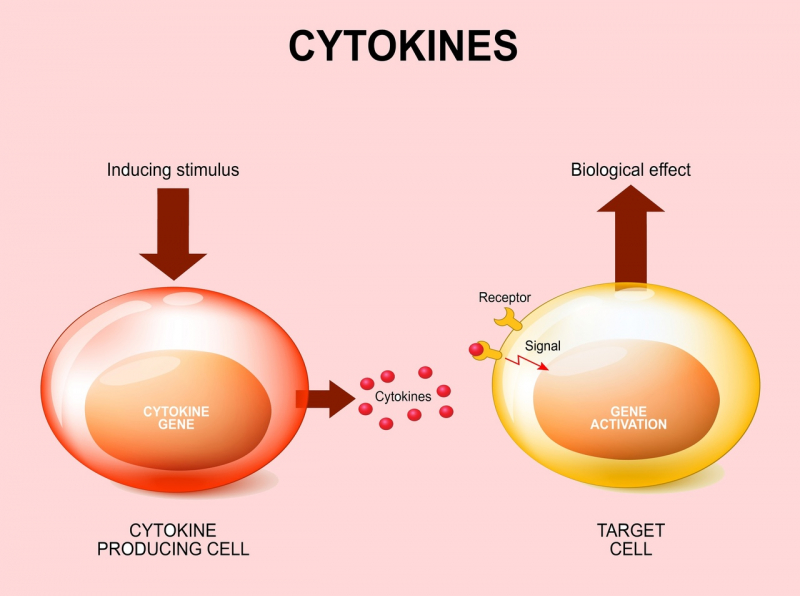
А что такое цитокиновый шторм?
Это выделение большого количества провоспалительных факторов ― цитокинов, в первую очередь, клетками иммунной системы, но также и другими неспецифическими клетками организма, которые приводят к усиленной активации иммунного ответа. Этот иммунный ответ необходим для уничтожения вирусных и бактериальных частиц, но одновременно слишком сильный цитокиновый шторм, слишком сильная активация иммунитета является фактором риска для здоровых тканей, что может привести к системному воспалению — здесь речь о том, что хорошо известно под названием «сепсис».
В принципе любое сильное воспаление приводит к цитокиновому шторму, вопрос в масштабах. Цитокиновый шторм может быть локальным, затрагивать соседние органы или весь организм: тогда развивается поражение сердечно-сосудистой системы, повышается уровень цитокинов в крови, что может приводить к воспалению других органов (печени, почек).
Ученые сейчас понимают, почему именно вирусные пневмонии влекут столь сильную ответную реакцию?
В первую очередь это связано с тем, что вирусы очень мутагенны, они способны меняться, и каждый новый вариант, новый штамм, вызывает сильный иммунный ответ, поскольку организм не готов к столкновению с этой вирусной частицей.
Соответственно, в организме пациента происходит неконтролируемое размножение вирусных частиц. Чем больше их становится, тем сильнее активация иммунного ответа — локального и системного.
На бытовом уровне считается, что пневмония при вирусе — это бактериальное осложнение. Поэтому его и лечат антибиотиками. Получается, это не совсем так?
При вирусной инфекции сначала развивается первичная пневмония, вирусной природы. В то же время активация противовирусного иммунитета ведет к ослаблению иммунной системы при столкновении с другими патогенами, что является фактором риска для последующего присоединения бактериальной инфекции.
Более того, в некоторых случаях, если у пациента имеются хронические нарушения иммунитета, к картине болезни может присоединяться не только бактериальная, но и грибковая инфекция. Подобные осложнения могут приводить не только к пневмонии, но и к другим патологиям: например, могут присоединяться кишечные инфекции.

Как возникает пневмония
В своей статье вы разбираете механизмы иммунного ответа. Расскажите о них подробнее.
Современная наука соглашается в том, что это сложный процесс, в котором играют важную роль несколько популяций клеток. В нашем обзоре мы уделяем основное внимание макрофагам.
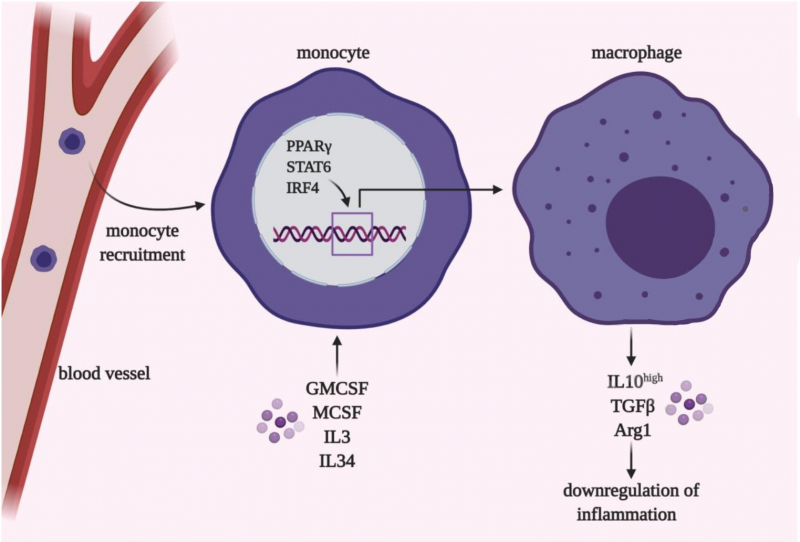
Это клетки врожденного иммунитета, которые присутствуют во всех тканях организма, в том числе и в легких. Циркулирующие популяции, называемые моноцитами, находятся в крови. Моноциты и макрофаги ― это именно те клетки, которые в первую очередь начинают взаимодействовать с патогеном, который попадает в наш организм.
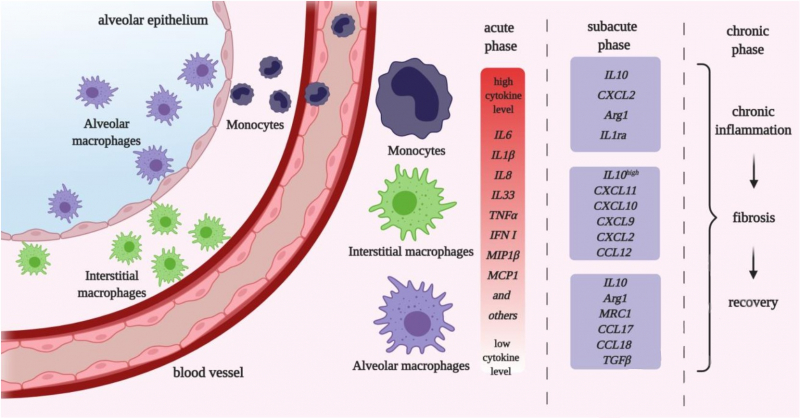
Макрофаги и моноциты начинают производить провоспалительные цитокины, которые и становятся частью цитокинового шторма. В первую очередь продукция цитокинов необходима для того, чтобы поддерживать иммунный ответ против вируса или бактерии, в том числе для активации специфического адаптивного иммунитета. Однако цитокиновый шторм также является фактором риска повреждения собственных тканей организма при чрезмерной активации.
Уже известно, что цитокины выделяются не только клетками иммунной системы, но и дыхательным эпителием легких и соединительной тканью. Кроме того, сами макрофаги и моноциты гетерогенны: существует несколько субпопуляций, которые имеют разную предрасположенность к секреции про- и антивоспалительных цитокинов.
Проще говоря, часть популяций выделяют большое количество провоспалительных медиаторов и становятся посредниками при развитии цитокинового шторма, в то время как другая часть клеток необходима для того, чтобы останавливать воспаление и участвовать в регенеративных процессах на более поздних стадиях пневмонии.
Соответственно, баланс между различными популяциями моноцитов и макрофагов является одним из важных факторов, определяющих исход заболевания и тяжесть его течения для каждого конкретного пациента.
Но если в нашем организме все так гармонично устроено, что у нас есть часть клеток иммунной системы, которые стимулируют воспаление, чтобы уничтожить инфекцию, а есть другие клетки, которые это воспаление успокаивают, почему же у нас развиваются тяжелые воспалительные процессы? Получается, что этот баланс как-то сбивается?
Первое: тут есть определенная генетическая предрасположенность. Наш обзор подготовлен вместе с Алексеем Комиссаровым, экспертом по геномике и руководителем лаборатории прикладной геномики Университета ИТМО. Анализ, проведенный Алексеем и его коллегами, показал, что есть определенные генетические вариации в первую очередь цитокинов и их рецепторов, связанных с дисбалансом иммунной системы, с более высокой продукцией и активностью провоспалительных цитокинов.
Второе: все популяции моноцитов и макрофагов достаточно пластичны. Для каждой конкретной клетки неизвестно, будет ли она обладать про- или антивоспалительной активностью. В связи с этим у каждого конкретного пациента может образовываться разное количество клеток с разными функциями. И это также может влиять на способность иммунитета, во-первых, противостоять вирусам, во-вторых, вовремя останавливать воспаление, определяя таким образом тяжесть заболевания.
Более того, избирательно манипулируя разными популяциями наших иммунных клеток, мы можем успешно ограничивать как размножение вирусов, так и стимулировать выздоровление и восстановление легочной ткани на более поздних стадиях.
То есть получается, что один человек более генетически предрасположен к пневмонии или абсцессу, а другой наоборот?
Для части людей мы можем сказать, что это верно. Для других — генетическая связь с течением болезни не показана. Мы не знаем наверняка, возможно, эта связь еще не найдена или имеют место другие причины.
Удалось ли современной науке понять, отчего конкретные макрофаги начинают работать по анти- или провоспалительному сценарию? Есть ли понимание, из-за чего может происходить сбой, и количество макрофагов, начинающих способствовать воспалению, перекрывает количество клеток иммунной системы, которые с воспалением борются?
Во-первых, соотношение воспалительных и антивоспалительных популяций, как я уже говорила, может быть связано с генетическими механизмами.
Во-вторых, уровень активации макрофагов связан с количеством вирусных частиц. То есть чем больше к нам в организм изначально попадает вирусных частиц, чем более активно они размножаются, тем больше вероятность сильного воспалительного ответа.
Ну и, наконец, самое интересное, что вирусные частицы способны активно взаимодействовать с иммунной системой. Они тоже влияют на то, как будут работать макрофаги. Здесь это зависит от штамма, с которым мы имеем дело.
То есть какой-то вирус проникает в организм и «выключает» воспалительный сценарий развития наших иммунных клеток, а какой-то наоборот, подавляет выделение антивоспалительных цитокинов?
Именно так.

Что предлагают ученые
Если я правильно понял, на баланс воспалительных и антивоспалительных цитокинов могут воздействовать не только вирусы, но и мы сами с помощью каких-то видов терапии?
Можем, да.
Как?
На данный момент это все экспериментальные терапии, мы пока не можем достаточно точно регулировать именно те клеточные популяции, на которые нацеливаемся. В первую очередь потому, что экспрессия белков-мишеней недостаточно специфична. В идеале хотелось бы, конечно, воздействовать даже не на популяцию ― на одну конкретную клетку организма. На данный момент, науке и медицине доступен анализ единичных клеток организма, но не терапевтическое воздействие на отдельную клетку ― именно эта стратегия станет ключевой для медицины будущего.
Наиболее перспективные методы связаны с воздействием на транскрипционные факторы, то есть на белки, которые могут связываться с ДНК и регулировать экспрессию большого количества генов, например, про- или антивоспалительных.
Мы знаем, что есть иммуностимулирующие макрофаги, а есть клетки, подавляющие иммунный ответ. В связи с этим, конечно, наиболее перспективной представляется активация воспалительной активности отдельных клеток на ранних стадиях для последующего уничтожения вируса.
Позднее эта терапия должна сменяться другой, способствующей увеличению количества антивоспалительных макрофагов и регенерации легочной ткани, когда вирус уже уничтожен.

А как мы можем контролировать на то, как макрофаг будет работать, по какому сценарию?
На самом деле могут быть использованы различные подходы. Во-первых, антитела, химические ингибиторы или активаторы соответствующих рецепторов, сигнальных путей, транскрипционных факторов в наших иммунных клетках. Это могут быть и подходы генной терапии, возможные для редактирования ДНК (генома) или РНК (транскриптома) иммунных клеток, но этот подход более адекватен для пациентов с врожденными проблемами иммунитета.
Насколько эти методы экспериментальны? На каком уровне находятся исследования ученых?
В принципе зависит от ситуации. Большинство сейчас на этапе испытаний на животных. На животных многие подходы показали эффективность.
То есть, грубо говоря, в ближайший год-два нам пока этих методов не ждать?
Генетического редактирования против вирусов пока ждать не стоит. А вот химиотерапевтические подходы, скорее всего, будут введены в текущей обстановке в ближайший год, уже, возможно, в 2021 году.
А насколько исследования этого вопроса были спровоцированы пандемией коронавируса?
Конечно, пандемия, вызванная коронавирусом SARS-CoV-2, стала большим толчком для развития иммунотерапии, но эти исследования базируются на большом количестве ранее полученных данных.
SARS-CoV-2 не первый вирус, с которым мы сталкиваемся. До этого были эпидемии, вызванные SARS-CoV и MERS, каждый год повторяются эпидемии гриппа, что всегда привлекает внимание исследователей к вирусным пневмониям. Их механизмы отчасти похожи, что позволяет проводить блестящие трансляционные исследования и применять ранее выработанные подходы.

А есть ли исследования, которые показывают, что механизм вирусной пневмонии при COVID-19 отличаются от вирусной пневмонии при других инфекциям?
Базовые принципы развития противовирусного ответа достаточно сходны, хотя и различия, безусловно, имеются. С точки зрения вирусологии и иммунологии эти различия не так велики, а вот с точки зрения терапии разница есть, и именно на нее нацелено внимание ученых.
К примеру, каждый вирус по-разному взаимодействует с иммунной системой, отличается от других некоторых вирусов. Например, SARS-CoV-2 подавляет активацию макрофагов и может успешно избегать иммунного ответа до определенного момента, пока количество частиц не становится большим.
Накопление большого числа частиц ведет к развитию сильного цитокинового шторма. Здесь важно понимать, что все эти механизмы отличают патогенез COVID-19, но не уникальны для него.
Какая работа в связи с этим ведется в ИТМО?
Наша лаборатория занимается исследованиями регуляции транскрипционного ответа в моноцитах и макрофагов в контексте вирусной инфекции. Мы изучаем, как клетки начинают работать по про- или антивоспалительному сценарию. В первую очередь это связано с изучением иммунного ответа в контексте сезонной пневмонии. Мы работаем над развитием подходов, позволяющих предотвратить развитие цитокинового шторма. С помощью наших исследований мы надеемся создать свой подход для иммунорегуляции при вирусных инфекциях.




