Белки играют огромную роль в поддержании жизненных процессов. Именно эти молекулы обеспечивают в клетках такие реакции, как репликация ДНК и катализ метаболизма. Когда белки погибают, происходит денатурация – разворачивание их нативной пространственной структуры, что, в свою очередь, ведет к потере их активности. Собрав развернутый полимерный клубок обратно, то есть совершив ренатурацию, можно вернуть белку прежние свойства, однако для этого требуется немало усилий. Денатурированные белки зачастую спутываются в токсичные соединения, являясь причиной серьезных заболеваний, таких как болезни Альцгеймера, Паркинсона и Хантингтона. По этой причине исследование механизмов денатурации и ренатурации белков сегодня является одним из наиболее привлекательных научных направлений.
В работе ученые Владимир Виноградов, заведующий лабораторией растворной химии передовых материалов и технологий Университета ИТМО, и Давид Авнир, профессор Еврейского Университета в Иерусалиме, впервые показали, что полный возврат белков к жизни не просто осуществим, но также может быть выполнен с увеличением их изначальной естественной активности. Добиться такого результата удалось благодаря новому способу ренатурации белков, основанному на смешении денатурированных белковых молекул (карбоновая ангидраза) с коллоидным раствором неорганических наночастиц оксида алюминия.
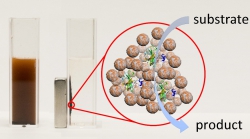
Оказалось, что при переходе коллоидного раствора в гель наночастицы начинают сшиваться друг с другом, оказывая на молекулы белка механическое давление. В результате каждая белковая молекула попадает в индивидуальную пористую оболочку из наночастиц, что препятствует губительному спутыванию белков и в конечном итоге возвращает белкам их исходную пространственную структуру, а значит и активную функцию.
Сравнив эффективность белков до денатурации и после ренатурации, химики обнаружили, что воскресшие белки стали на 180% эффективнее, чем их нативные предшественники. Связано это с тем, как белок вступает в реакцию с окружающим его субстратом.
«У каждой белковой молекулы есть свой активный центр, за счет которого происходит взаимодействие со средой. Этот активный центр составляет всего 5–10% от всей поверхности белка, все остальное – это своеобразный балласт, – рассказывает Владимир Виноградов. – При ренатурации мы имеем длинную вытянутую молекулу с активным центром и расходящимися в разные стороны хвостами. Активный центр и наночастицы оксида алюминия имеют один заряд, поэтому будут отталкиваться, а вот хвосты имеют другой заряд и будут притягиваться к наночастицам. Получается так, что активный центр окажется максимально далеко от стенки оболочки и будет вывернут прямо по направлению к поре, оставаясь доступным для взаимодействия с субстратом».
По словам ученых, если провести такую процедуру с нативным белком, то ориентацией молекулы внутри матрицы управлять будет невозможно. В нативном состоянии активный центр белка с большой степенью вероятности может оказаться у стенки матрицы, что полностью исключит доступность активного центра для субстрата.
Как пояснил соавтор исследования Давид Авнир, открытие может быть использовано для оптимизации производства лекарств на основе активных белков.
«Большинство наиболее эффективных лекарств сегодня основаны именно на белках, которые получают из живых клеток. Однако среди выработанных таким образом белков лишь около 20% являются нативными и годны к использованию, в то время как остальные 80% составляют так называемые тела включения – тоже белки, но денатурированные. Очевидно, что возможность перевода денатурированных белков обратно в активное состояние, да еще и с повышенной эффективностью, позволило бы удешевить производство многих лекарств и сделать их более доступными», – объясняет ученый из Еврейского Университета в Иерусалиме.
Начальник отдела по научным коммуникациям Университета ИТМО