Умные цепочки ДНК
Для лечения онкологических заболеваний генетики развивают разные генно-терапевтические подходы. Но, чтобы создать действительно эффективный противораковый препарат, ученым необходимо решить три основные проблемы: как доставить лекарство внутрь клетки, как повысить его эффективность и как увеличить его селективность. Обычно препараты атакуют гены, которые ответственны за развитие рака или устойчивости к химиотерапии, но, чтобы победить заболевание, этого недостаточно. В качестве мишени нужно использовать гены, отвечающие за устойчивость клеток к апоптозу — программируемой гибели.
Классический генно-терапевтический подход антисмысловых олигонуклеотидов не годится для подавления таких генов в терапии онкологических заболеваний, так как иначе апоптоз может затронуть все клетки в организме, а это ― большой риск для человека. Ученые часто обращаются к использованию антисмысловых олигонуклеотидов — давно известной и простой технологии, которая применяется в молекулярной биологии. Работает она так: сначала одноцепочечные фрагменты ДНК находят свою целевую молекулу в клетках и формируют с ней пару по принципу комплементарности. Далее ферментативная система внутри клетки распознает это парное соединение и разрушает целевую молекулу, которая связана с антисмысловым олигонуклеотидом.
Эта технология позволяет ученым регулировать функции разных генов, но при этом антисмысловой агент не может включаться и выключаться при определенных условиях, когда это нужно исследователям. Сотрудники лаборатории «Передовые технологии нуклеиновых кислот в генной терапии рака» SCAMT доработали технологию и предложили концепцию бинарного антисмыслового агента. Он представляет собой два олигонуклеотида: один из них — это терапевтический модуль, который ищет целевую молекулу и связывается с ней, задача же второго, сенсорного модуля — обнаружить онкомаркер. Оба участка цепи связываются между собой химическим линкером — гибкой химической ниточкой. Процесс расщепления целевой молекулы в бинарном антисмысловом агенте такой же, как и в классическом, и проходит с помощью ферментов.
«Мы решили усилить технологию антисмыслового олигонуклеотида — теперь вместо одной цепи мы делаем модификацию, чтобы агент распознавал не одну целевую молекулу, а две. Созданные нами бинарные антисмысловые олигонуклеотиды, с одной стороны, находят нужную им молекулу РНК гена, которую должны разрушить, а с другой — онкомаркер в раковых клетках. Таким образом, наша технология может позволить c большей эффективностью убивать клетки с онкологическим заболеванием и оставлять нетронутыми здоровые ткани, в которых нет онкомаркеров», — объяснила первый автор статьи и магистрантка второго курса химико-биологического кластера Валерия Дрозд.
Валерия Дрозд. Фото: Дмитрий Григорьев / ITMO.NEWS
Под прицелом только раковые клетки
Ученые протестировали бинарный антисмысловой олигонуклеотид в растворе с искусственным ферментом РНКазой H на целевой молекуле гена GFP — это зеленый флуоресцентный белок, который светится в клетках. В качестве онкомаркера взяли фрагмент гена KRAS, который связан с возникновением рака у человека. Исследователи пытались подвергнуть деградации РНК гена GFP, чтобы протестировать процесс снижения флуоресценции. Предполагалось, что эта задача поможет понять, как влияет новая терапия на клетки: действительно ли разработанный агент подавляет выбранный ген или она настолько токсична, что сама по себе приводит раковые клетки к гибели.
Во время измерения эффективности системы ученые отслеживали разницу между тем, насколько высоким получился процент расщепления целевой молекулы в присутствии онкомаркера и насколько низким он был в его отсутствие. В итоге за 20 минут эксперимента бинарному антисмысловому агенту удалось расщепить 9% молекулы без онкомаркера и около 53% — вместе с ним, а это в шесть раз эффективнее результата без онкомаркера.
«Также мы протестировали нашу систему на распознавание мутаций в онкомаркерах. РНК генов, которые можно взять в качестве онкомаркеров, могут проявляться как в здоровых, так и раковых тканях. В последнем случае РНК будет иметь какую-либо мутацию, то есть одну букву в цепи заменит другая, и ее нам тоже нужно распознать, чтобы наше устройство активировалось именно на специфическую последовательность в раковых клетках», — добавила Валерия Дрозд.
А. Принцип работы одноцепочечного антисмыслового олигонуклеотида (АСО). АСО и мРНК целевого гена формируют пару. Фермент РНКаза H разрезает в паре мРНК целевого гена, АСО высвобождается и готов искать следующую молекулу-мишень. Б. Принцип работы бинарных антисмысловых олигонуклеотидов. Онкомаркер объединяет БиАСО цепи в общую систему и активирует расщепление мРНК жизненно важного гена, также как АСО. Схемы представлены исследователями.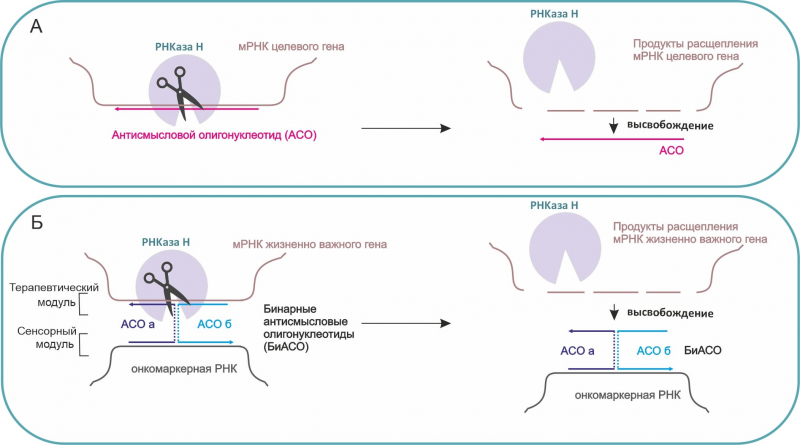
В целом эффективность технологии зависит от многих факторов: например, чтобы ее применять в реальной практике, генетикам надо удачно определить уязвимый ген, выключение которого может вызывать апоптоз клеток, и подходящий онкомаркер. Это непросто, поэтому ученые уже развивают свой метод и ищут уникальные гены, подавление которых приводило бы к гибели всех или большинства типов раковых клеток.
Также перед тем, как тестировать бинарный антисмысловый олигонуклеотид в клетках организма, исследователям предстоит решить еще несколько вопросов ― и один из них: как модифицировать конструкцию, чтобы она не разрушалась внутри клетки до того, как окажет терапевтический эффект. При этом любая химическая модификация изменяет свойства олигонуклеотида, поэтому нужно соблюсти баланс между эффективностью агента и его устойчивостью к защитным системам организма. Помимо этого, в перспективе ученые планируют создать структуры на основе малых интерферирующих РНК, так как они более эффективны в генной терапии.
Подробнее об исследовании: Valeriia Drozd, Ahmed Eldeeb, Dmitry Kolpashchikov, Daria D. Nedorezova Binary antisense oligonucleotide (biASO) agent for cancer marker-dependent degradation of targeted RNA (Nucleic Acid Therapeutics, 2022).
Работа выполнена за счет гранта Российского фонда фундаментальных исследований (проект № 20-34-90071) в рамках государственной программы поддержки и развития университетов «Приоритет-2030», а также поддержана программой «УМНИК» (№ 17789ГУ/2022).