Что такое ДНК-машины и причем тут роботы
Понятие ДНК-роботов или ДНК-машин придумали не в ИТМО и не в SCAMT — это общепринятое название для искусственных молекул — интеллектуальных систем, которые состоят исключительно из нуклеиновых кислот. Суть в том, что при определенных условиях такие структуры обладают рядом уникальных функций: они могут находить и связываться с «мишенями» (определенными цепочками ДНК или РНК), расщеплять или менять их пространственную организацию («расплетать» цепочки), блокировать их репликацию или доставлять в клетку терапевтические агенты.
В основе этих искусственных соединений находятся каталитические молекулы дезоксирибозимы, которые обладают ферментативной активностью: они умеют ловить и накапливать магний, а при достижении определенной его концентрации — расщеплять мишень. То есть робот заходит в клетку, по определенным маркерам опознает ее как раковую или инфицированную, присоединяется к цепочке и блокирует работу жизненно важных генов этой клетки — что в конечном счете приводит к ее гибели.

При этом в системе есть ряд защит, предотвращающих уничтожение здоровых клеток — достаточно даже одной нуклеотидной замены в маркерной последовательности для того, чтобы начать ингибировать сборку роботов. Важно, что ДНК-роботы не являются белками — а значит для их хранения не нужно соблюдать специфические условия.
Этот же принцип мы используем в диагностике для типирования, например, единичных нуклеотидных замен, что довольно сложная задача в диагностике.
В SCAMT такими исследованиями занимается лаборатория Дмитрия Колпащикова «Молекулярная робототехника и сенсорные материалы». Работа в основном ведется по двум направлениям: использование ДНК-роботов и ДНК-наномашин для терапии раковых и инфекционных заболеваний и создание ДНК-сенсоров и тест-систем для диагностики.

Использование ДНК-сенсоров на основе ДНК-роботов для диагностики
Наша команда, объединившая сразу семь лабораторий Химико-биологического кластера, в данный момент занимается разработкой системы экспресс-диагностики инфекционных заболеваний ЦНС — по заказу Федерального медико-биологического агентства России. Мы уже разработали рабочий прототип диагностической платформы и провели тестовые клинические испытания с нашими партнерами: НИИДИ, НИИ Гриппа, НИИ Эпидемиологии и микробиологии Пастера, которые предоставили нам биологические и клинические образцы для исследований.
Инфекционные поражения центральной нервной системы (менингит, энцефалит) являются причиной высокого уровня смертности и приводят к инвалидизирующим последствиям при недостаточно быстро оказанном лечении.
Главная проблема, которая стоит перед медиками, ― это всевозможные ограничения, которые растягивают процесс диагностики на недопустимые в данном случае сроки. Сейчас в большинстве случаев для экспресс-диагностики применяются молекулярно-генетические методы, однако они позволяют анализировать весь спектр возможных возбудителей и требуют специального оборудования и квалифицированного персонала. Часто анализы отправляются в специальные лаборатории, что отнимает много времени и требует продуманной транспортировки.
Перед нашим коллективом была поставлена задача разработать такую систему, которая была бы максимально быстрой, удобной, мобильной и автоматизированной — чтобы с ней справился даже необученный медперсонал. При этом система должна выявлять как можно более широкий спектр возбудителей — бактерий, вирусов и грибов — и иметь возможность работать при любых условиях.
Решить эту задачу стало возможным благодаря использованию наших сенсоров.
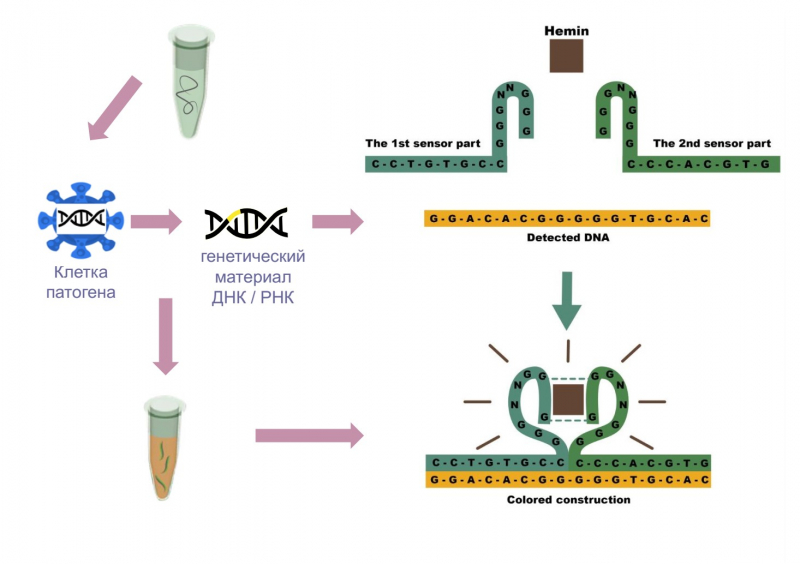
Наш ДНК-сенсор состоит из двух частей: двух последовательностей, узнающих РНК патогена, и двух половинок G-квадруплекса (тетрада гуанина). Когда в растворе появляется специфическая матрица — например, ДНК или РНК патогена — система собирается из двух половинок и формирует G-квадруплекс. Это запускает ряд каталитических реакций — что в конечном счете приводит к окрашиванию исследуемого образца в коричневый цвет.
Такая визуально наблюдаемая реакция — это очень удобно, потому что для обнаружения патогенов не нужно дополнительное оборудование. То, что мы не используем в системе белки, делают систему более стабильной при длительном хранении, снижает ее стоимость. Среди других ее преимуществ стоит отметить высокую селективность (даже одна нуклеотидная замена заметно ингибирует сборку, что исключает ложноположительные ответы) и пластичность технологии (в дальнейшем могут быть разработаны наборы для любого спектра инфекций). Одновременная детекция сразу 16 патогенов также делает нашу систему уникальной — аналогов для такого большого числа мишеней ни на российском, ни на западном рынке нет.
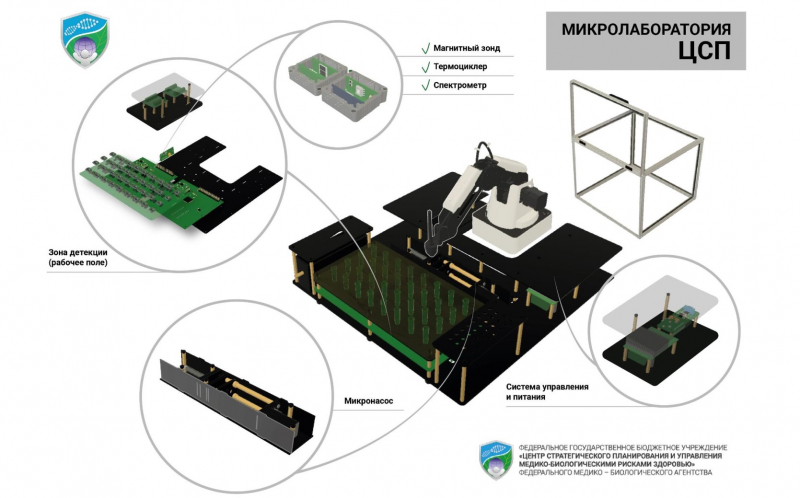
Схема работы системы
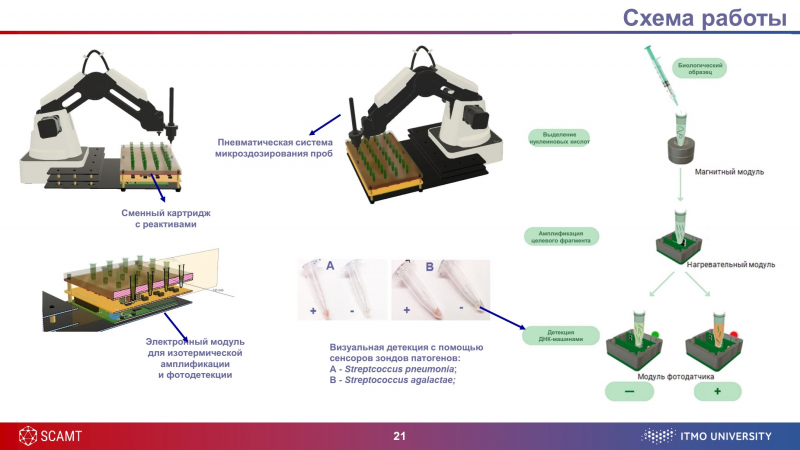
В нашем приборе присутствуют все этапы работы с биологическим материалом. На первом этапе происходит разрушение оболочек патогенов (этот процесс называется «лизис») — так мы выделяем ДНК или РНК. Далее прибор амплифицирует фрагмент — накапливает его химической реакцией с участием солей, ферментов и других химических веществ.
В классических методах обычно используется вариант циклирования с постоянным изменением температуры в специальном оборудовании — термоциклере. Мы используем метод изотермической амплификации типа NASBA в пробирке при небольшом подогреве до 41 градуса. Более того, мы разработали свои собственные ферменты для реакции, чтобы не зависеть от поставщиков.
Далее к накопленной в процессе амплификации РНК присоединяются олигонуклеотиды, которые образуют ДНК-сенсор, а затем необходимые для визуальной реакции компоненты (гемин, пероксид водорода и диаминобензидин). В итоге, если в исследуемом образце биологической жидкости присутствовал патоген, происходит реакция и пробирка окрашивается в коричневый цвет, если нет — остается прозрачной.
Отдельно стоит рассказать, как происходит дизайн сенсоров. Мы берем какой-то патоген — допустим, кишечную палочку, — биоинформатическими методами находим наиболее консервативный и стабильный участок, который будет одинаковым абсолютно у всех кишечных палочек, и на этом участке выбираем оптимальную мишень для наших сенсоров, которая будет накапливаться на этапе амплификации. Длина мишени составляет от 80 до 160 пар нуклеотидов.
Одноцепочечная РНК, которую находят машины, в растворе обычно имеет не линейную форму, а свернутую. Это представляет определенную проблему для классических методов диагностики, потому что такие свернутые структуры очень стабильны и самодостаточны — сложно заставить что-либо внешнее «сесть» на них. Мы же наоборот используем это особенность для наших целей — потому что наш сенсор умеет «распрямлять» эту свернутую структуру и выявлять в ней целевые участки.
Роборука вместо лаборанта
Всю химическую часть разработки нам было необходимо заключить в некий прибор — в этом нам помогла индустриальная лаборатория SCAMT под руководством Александра Виноградова. Нам удалось создать прототип автоматизированной микролаборатории, в основе которой — роботизированная рука и платформа с несколькими модулями и сменным картриджем с реактивами. Для каждой инфекции в картридже своя ячейка с сенсорами.
Важно, что мы не используем отдельные флюорофоры для каждого патогена, как это происходит, например, при ПЦР в реальном времени, — иначе при одновременном анализе нам бы не хватило каналов. Если в результате реакции образец стал коричневым — на это реагирует фотодатчик.
Фактически, система заменяет собой лаборанта: она перемещает образцы по пробиркам, перемешивает их, добавляет необходимые реагенты и так далее. Под каждую задачу есть собственный модуль: нагревательный — для амплификации; магнитный — для выделения и очистки ДНК с помощью магнитных частиц, разработанных в лаборатории нанофармацевтики SCAMT; и модуль фотодатчиков — для точной детекции изменения цвета образца.
Вся установка находится в боксе — герметичной системе со встроенной функцией очистки и дезинфекции, полностью изолированной от оператора. Это позволяет отказаться от специального оборудования и отдельного помещения при работе с образцами.
В будущем мы планируем миниатюризировать устройство, сделать его портативным и автономным от сети питания. Этот проект будет продолжен еще в течение одного года — так что в 2021 мы планируем доработать прототип, и провести дополнительные испытаниям в медучреждениях. Предварительные клинические исследования при участии НИИДИ показали высокую точность работы системы и многообещающие результаты.