Как генетика влияет на развитие аутоиммунных заболеваний
Сейчас известно около 140 аутоиммунных заболеваний ― это в том числе псориаз, диабет первого типа, ревматоидный артрит и болезнь Крона. Эти заболевания вызывают антитела, которые атакуют собственный организм. Большинство аутоиммунных патологий невозможно вылечить, но можно добиться их ремиссии.
Значительный вклад в развитие аутоиммунных заболеваний и аллергии вносят изменения в работе генов — так называемые регуляторные нарушения. Чтобы определить, какие конкретно генетические изменения влияют на регуляцию генов и развитие тех или иных заболеваний, ученые проводят картирование — ищут локусы (участки) генома человека, в которых находится нарушение, связанное с заболеванием. На этом этапе исследователи получают данные о протяженном участке генома с десятками генов, которые могут содержать тысячи генетических изменений. Этот этап картирования дает лишь грубую фокусировку на большие участки генома, где находятся искомые генетические изменения (варианты). Кроме того, существующие способы картирования основаны на чиповых данных, когда геном покрывают маркерами через каждые шесть тысяч нуклеотидов, а не прочитывают. Недостаток такого метода в том, что он имеет низкую разрешающую способность картирования, при которой невозможно увидеть все разнообразие нуклеотидных изменений генома.
Чтобы двигаться дальше и выявить нарушения в конкретных генах, ученые ИТМО совместно с эстонскими коллегами провели тонкое картирование генетических факторов внутри локусов генома. Для этого они использовали данные целиком прочитанного генома из биобанка Тартуского университета.
«Мы решили подойти к проблеме аутоиммунных заболеваний с точки зрения эволюционной геномики и предположили, что часть генетических нарушений, которые вызывают эти заболевания, являются эволюционными адаптациями. Они закреплялись в иммунной системе в процессе эволюции, чтобы мы лучше боролись с патогенами. За этими адаптациями стоят генетические изменения, и если раньше они помогали нам выживать, то сегодня, когда существуют больницы и антибиотики, они проявляют свою оборотную сторону и вносят вклад в развитие аутоиммунных и аллергических заболеваний. В биологии есть такая гипотеза “заплати потом”, согласно которой эволюционные изменения закреплялись только для того, чтобы организмы выжили и дали потомство — дальнейшие последствия в виде склероза, диабета, псориаза и других аутоиммунных заболеваний не так важны для эволюции», — рассказывает соавтор исследования и руководитель научной группы «Эволюционная биомедицина» в SCAMT Баязит Юнусбаев.
Баязит Юнусбаев. Фото: Дмитрий Григореьв / ITMO.NEWS
Для поиска конкретных нуклеотидных изменений в уже изученных регионах, которые отвечают за развитие аутоиммунных заболеваний, авторы работы применили биоинформатические методы — моделировали и реконструировали эволюционный процесс генетических изменений в конкретном регионе генома с помощью вычислений на суперкомпьютерах. В ходе исследования они использовали подход Relate для реконструкции генеалогии маленьких кусочков генома, где содержатся SNP-кандидаты риска (снипы) — однонуклеотидные изменения генома, связанные с заболеванием. После реконструкции генеалогии SNP-кандидатов ученые использовали алгоритм CLUES для вычисления вероятности нейтральной или адаптивной эволюции, который выявляет следы естественного отбора в данном участке.
Результаты исследования
Научная группа проанализировала базу данных из более чем 2300 секвенированных геномов человека — из них выделили 535 геномных локусов (участков), связанных с риском аутоиммунных и аллергических патологий. Всего исследовательская группа изучила 21 патологию: диабет первого типа, астму, артрит, псориаз и другие.
Работа показала, что около трети изученных локусов риска (204), связанных с аутоиммунными и аллергическими заболеваниями, находились под влиянием естественного отбора. Также выяснилось, что в 40% случаев наиболее вероятные нуклеотидные замены, связанные с болезнью, являются, скорее всего, мишенью естественного отбора. В дальнейшем их можно использовать для функционального анализа — комплекса экспериментов на клетках и тканях, который покажет, за что отвечают те или иные нуклеотидные изменения в геноме.
Также ученые предположили, почему гены иммунной системы, отвечающие за развитие аутоиммунных заболеваний, активируются. Известно, что 90% предполагаемых генетических нарушений — регуляторные, то есть не затрагивают структуру белка, а выполняют свою функцию в ответ на внешний стимул. Эволюционная гипотеза указывает на то, что найденные учеными генетические варианты, скорее всего, активируют работу генов в ответ на вторжение вирусов и бактерий.
Кроме того, исследователи определили ткани и клетки иммунной системы, где искомые нуклеотидные варианты активируют свою функцию в работе иммунной системы. Например, в случае аутоиммунного тиреоидита такими клетками являются Б-лимфоциты, Т-лимфоциты, а также Т-регуляторные лимфоциты — на их поверхности увеличивается синтез рецептора FCRL3. Этот рецептор усиливает детекцию патогенов на слизистой кишечника и легких. Если эволюционно такой механизм мог быть выгоден, так как защищал организм от смертельных патогенов, то в условиях современности он увеличивает реактивность к симбионтным бактериям на слизистой кишечника и вносит вклад в развитие аутоиммунного тиреоидита. Таким образом, полученные учеными данные позволят решить вторую значимую проблему в геномике — выбор клеточной системы для экспериментов.
Концепт-схема отражает эволюционное закрепление адаптаций иммунной системы к патогенам. Предполагается, что данные адаптивные механизмы активируются в ответ на инфекционные триггеры аутоиммунных и аллергических заболеваний. Изображение предоставлено Баязитом Юнусбаевым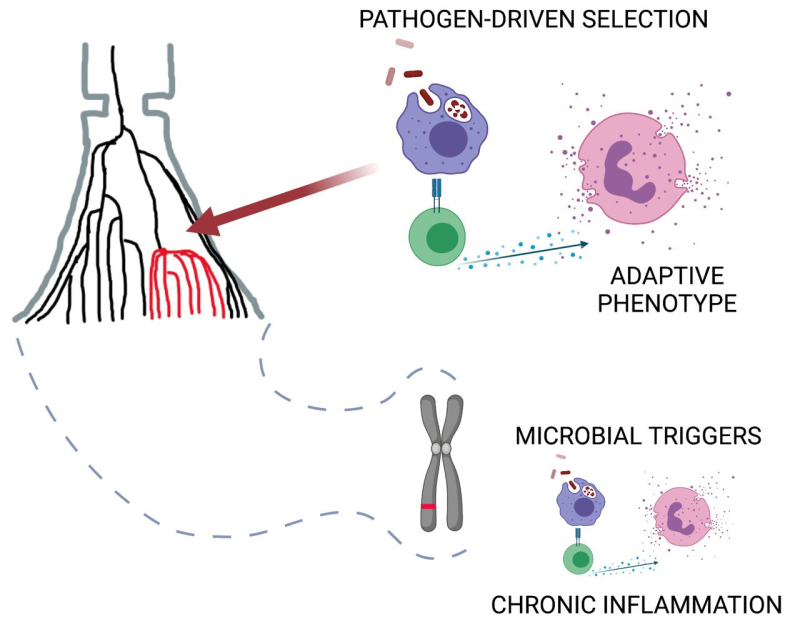
Что дальше
Результаты исследования могут помочь в развитии нового подхода к борьбе с аутоиммунными и аллергическими заболеваниями. Сегодня при лечении тяжелых форм аутоиммунных заболеваний применяют терапевтические моноклональные антитела, которые с разной степенью избирательности блокируют звенья иммунного ответа. Проблема таких препаратов в том, что помимо «вредных» иммунных реакций, которые вызывают заболевания, они могут ослаблять и те иммунные реакции, которые защищают нас от опасных инфекций, например, туберкулеза. Кроме того, иммунитет больного может со временем выработать резистентность к этим антителам, и лечение станет неэффективным.
Новое исследование показало, что терапия аутоиммунных заболеваний должна быть комплексной и обязательно включать подавление микроорганизмов, которые провоцируют развитие хронических вирусных и бактериальных инфекций (например, хронического тонзиллита, периодонтита и других). Разработка новых антибактериальные методов, которые будут устранять провоцирующие факторы болезней в виде хронических инфекций, избавит пациентов от симптомов аутоиммунных и аллергических заболеваний.
Следующий шаг ученых — провести эксперименты для проверки своих гипотез. Например, изучить, как конкретные вирусные и бактериальные провокаторы влияют на регуляцию генов, связанных с аутоиммунными и аллергическими заболеваниями. Так ученые планируют изучить на клетках иммунной системы пациентов, как меняется регуляция генов в ответ на инфекционные триггеры.
Статья: Vasili S. Pankratov, Milyausha M. Yunusbaeva, Sergei S. Ryakhovsky, Maksym Zarodniuk, Estonian Biobank Research Team & Bayazit B. Yunusbayev. Prioritizing autoimmunity risk variants for functional analyses by fine-mapping mutations under natural selection (Nature Communications, 2022).




