Одним из наиболее перспективных материалов в качестве носителей биоактивных соединений являются частицы карбоната кальция. Однако, чтобы эффективно применять такие частицы для упаковки лекарств, необходимо, во-первых, проверить их токсичность, а, во-вторых, тщательно изучить, как именно они распределяются в организме.
Сотрудники физико-технического факультета Университета ИТМО исследовали биораспределение частиц карбоната кальция в крысах с помощью позитронно-эмиссионной томографии (ПЭТ), а также разработали способы запаковки радионуклидов в носители. В ходе исследования выяснилось, что размер частиц напрямую влияет на область их распределения внутри живого организма. Результаты опубликованы в журнале «ACS Applied Materials and interfaces».
Карбонат кальция обладает множеством достоинств по сравнению с другими неорганическими материалами: он легко синтезируется и модифицируется, его можно сделать любой формы и размера, он нетоксичен и биосовместим. Покрытие частиц полимерами методом layer-by-layer («слой-за-слоем») помогает сделать эти носители более стабильными в организме и биологических жидкостях. В качестве полимеров можно использовать дубильную кислоту (tannic acid, TA) и белок плазмы крови (Human Serum Albumin, HSA).
Для исследования распределения компонентов внутри живого организма, то есть in vivo, существует несколько методов наблюдения, самыми распространенными среди которых являются спектроскопия в ближней инфракрасной области и биолюминесцентная томография. Но эти методы имеют свои ограничения, связанные, прежде всего, с недостаточным проникновением света в толщину тканей организма. Из-за этого получить высококачественную визуализацию довольно сложно.

Другой популярный метод in vivo-исследований — позитронно-эмиссионная томография (ПЭТ) — представляется более точным и удачным, ведь он позволяет наблюдать самые глубокие слои тканей, при этом дает весьма точную и высококачественную картину. Технология позволяет отслеживать распределение в организме биологически активных соединений, меченных радиоизотопами, при помощи детектирующего сканера. Главная задача для визуализации с помощью ПЭТ — доставить радионуклиды в необходимую область организма. Это можно сделать с помощью наночастиц.
Частицы карбоната кальция хорошо подходят для различных биомедицинских применений, но сейчас практически нет работ, посвященных использованию этих носителей в качестве агентов для ПЭТ. Также мало изучены и техники запаковки радионуклидов внутрь этих частиц.
Именно изучению методов исследования биораспределения частиц карбоната кальция с помощью позитронно-эмиссионной томографии — и, соответственно, разработке способов прикрепления радионуклидов к этим частицам — посвящено новое исследование сотрудников физико-технического факультета Университета ИТМО. Статья «Radiolabeling strategies of micron- and submicron sized core-shell carriers for in vivo studies» недавно была опубликована в журнале «ACS Applied Materials and interfaces».
Проект был выполнен в коллаборации с Российским научным центром радиологии и хирургических технологий имени академика А.М. Гранова.
Три стратегии маркировки
Для использования методов позитронно-эмиссионной томографии изучаемые частицы должны быть промаркированы радиоизотопами галлия. Но проблема в том, что нельзя просто взять и поместить радионуклид в частицу. Для этого нужно использовать специальную молекулу, которая способна связать металлические ионы с другими соединениями — хелатор. В работе использовался хелатор DOTA. Но получившийся галлий-DOTA комплекс — это низкомолекулярное соединение, поэтому он может вытекать через поры носителей. Чтобы исправить эту проблему, получившееся соединение необходимо модифицировать с помощью белка плазмы крови (Human Serum Albumin, HSA).
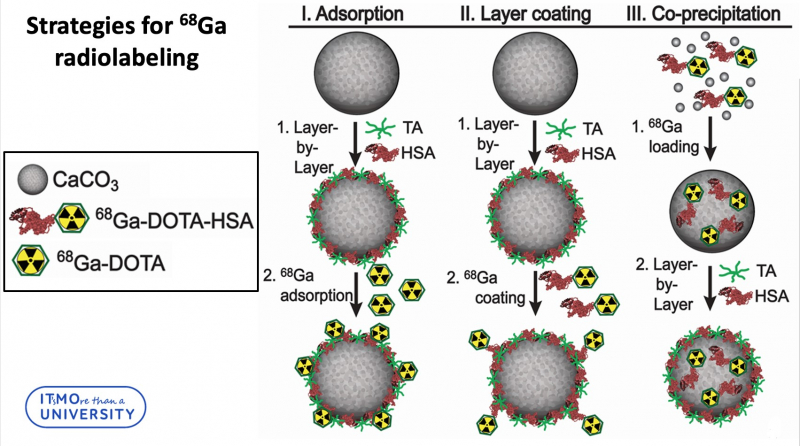
Далее вставал вопрос, как получившийся 68Ga-DOTA-HSA комплекс присоединить к частицам карбоната кальция. Исследователи разработали три стратегии для этого и выявили самую эффективную из них.
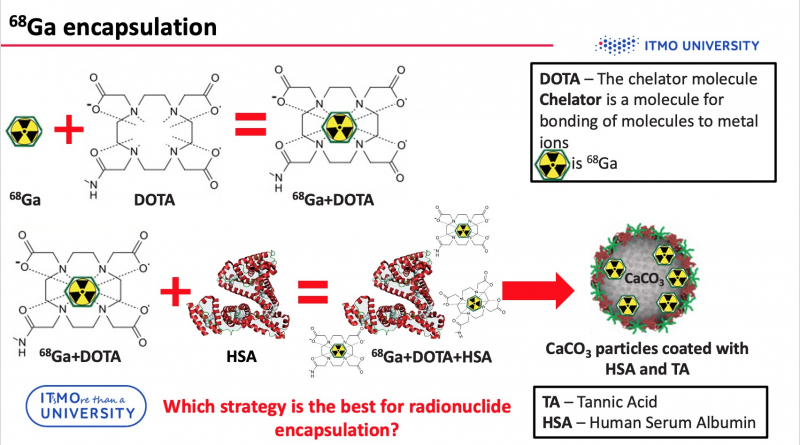
«Три наших стратегии запаковки можно разделить на две группы, — рассказывает Елена Герасимова, инженер физико-технического факультета и одна из авторов исследования. — Первая группа — когда мы загружаем комплекс в слой частицы, вторая — когда мы загружаем его непосредственно в ядро. Надо отметить, что у нас использовался не чистый карбонат кальция — наши частицы сделаны по технологии layer-by-layer, то есть частица еще дополнительно покрывался слоями полимеров. И вот мы можем либо внешним слоем нанести 68Ga-DOTA-HSA на дубильную кислоту (tannic acid, TA) и, либо мы можем оставить в последнем слое белок плазмы крови HSA и попробовать прикрепить 68Ga-DOTA непосредственно к нему. Третий способ — это загрузка радионуклида прямо в ядро частицы. Как раз такой метод мы признали наиболее эффективным: у него наибольшая стабильность в биологических жидкостях, а утечка радионуклидов в процессе эксперимента минимальна».
Как размер частиц влияет на область их локализации
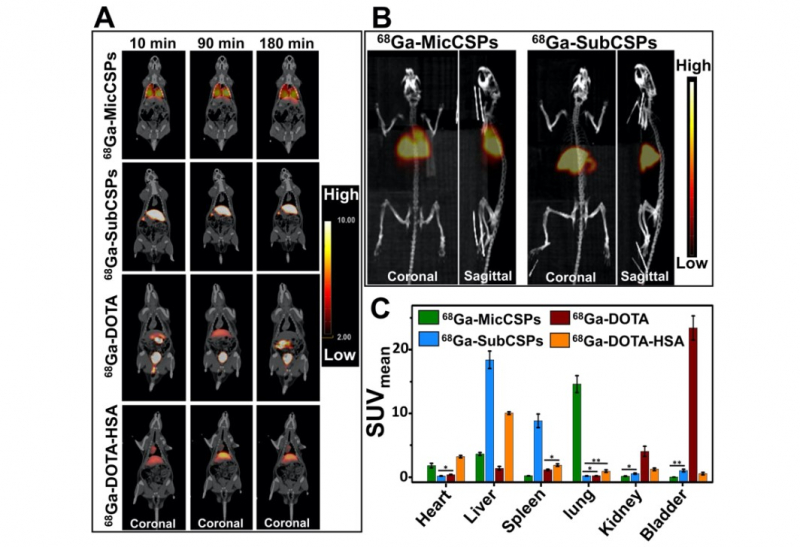
Другой важнейший результат исследования — была выявлена зависимость области концентрации частиц в организме от размеров этих частиц. Все эксперименты проводились на крысах — это первый подобный опыт в истории факультета.
Раствор с радиомеченными носителями кальций карбоната инжектировали в хвостовые вены крысы. Затем она помещалась в томограф, и в течение трех часов исследователи наблюдали, как частицы распределяются по организму. Для уточнения показателей ПЭТ после визуализации каждый орган крысы извлекли из тела животного и проверили на уровень радиоактивности — что полностью подтвердило результаты наблюдения.
Выяснилось, что для частиц микроразмера — то есть в районе 5 микрометров — область локализации находится в легких. А частицы субмикроразмера — около 500 нанометров — накапливаются в печени и селезенке.
«Сейчас мы исследовали пассивное накопление частиц, это значит, что мы их не модифицировали никакими специальными молекулами-поисковиками, либо молекулами, которые могут цепляться только к специфическим клеткам. Это наши основные, самые главные результаты, это была цель нашей работы. Ведь для будущих биомедицинских применений нам важно выяснить именно зону распределения частиц. Если мы говорим о микрочастицах, то они располагаются в легких — соответственно, если в дальнейшем мы захотим проводить диагностику заболеваний конкретно легких, мы можем использовать именно микрочастицы», — комментирует Елена Герасимова.
Возможности применения результатов исследования
Что касается реального применения результатов исследования в терапевтических целях — то это вопрос отдаленного будущего. Однако, перспективы довольно захватывающие: во-первых, дальнейшее изучение зависимости размера частиц от области их локализации и эксперименты с их уменьшением может значительно ускорить развитие области таргетной доставки лекарств. Ведь теперь мы будем знать, как именно нужно модифицировать частицы, чтобы они доставили действующее вещество в нужный орган, а не просто распределялись по организму.
Во-вторых, in vivo-наблюдения за распределением частиц открывает возможности для диагностирования и изучения развития раковых опухолей.
«Все больные ткани, например, раковые, имеют совершенно другую систему кровотока, нежели здоровые. И сама поврежденная ткань имеет очень большие поры — как раз сквозь них частицы могут гораздо проще проникать и скапливаться. Там, где они скапливаются, можно улучшить качество визуализации — так можно детектировать пораженные раком ткани и наблюдать, как развиваются раковые метастазы», — рассказывает Елена Герасимова.
Пока никаких дополнительных исследований не проводилось и об эффективности метода говорить еще рано. Сейчас исследователи планируют сосредоточиться на экспериментах с уменьшением размера частиц и их модификациями.
Статья: Mikhail Valeryevich Zyuzin, Dmitrii Antuganov, Yana Tarakanchikova, Timofey Karpov, Tatiana Mashel, Elena Gerasimova, Oleksii Peltek, Nominé Alexandre, Stéphanie Bruyère, Yulia Kondratenko, Albert Muslimov, and Alexander S. Timin. Radiolabeling strategies of micron- and submicron sized core-shell carriers for in vivo studies. ACS Applied Materials and interfaces, 2020.