Почему человек болеет раком?
Рак — это болезнь многоклеточных, так как для развития этого заболевания нужно, чтобы клетки делились. В обычном состоянии здоровые клетки многоклеточных организмов соблюдают определенные правила, которые помогают особи полноценно функционировать и оставаться здоровой. Раковая клетка, наоборот, ведет себя как бунтарь, который эти правила нарушает, распространяя свой дефектный генетический материал и, как следствие, вредит целому организму.
Что заставляет клетку вести себя именно так?
Главная причина, почему клетка приобретает свойства опухолевой — мутации ДНК или, иными словами, изменение последовательности нуклеотидов. Чаще всего к раку приводят мутации в онкогенах и онкосупрессорах. Появление мутаций провоцируют разные мутагенные факторы, которые постоянно воздействуют на клетки. Например, для клеток эпителия дыхательных путей — это курение, для печени — алкоголь и токсические вещества.
При этом мутации, которые запустят злокачественную трансформацию клетки, могут появиться и случайно. При каждом делении клетки происходит удвоение ее ДНК, и этот процесс естественным образом сопровождают ошибки. Чем дольше клетка живет и чем больше циклов деления претерпевает, тем больше у нее вероятность накопить набор мутаций, который приведет к появлению опухолевых свойств. Частично поэтому риск онкологических заболеваний увеличивается с возрастом.
Онкогены — это гены, которые в случае активации будут способны дать клетке одно из свойств, которое может привести к тому, что она станет злокачественной. Гены, которые мутируют, чтобы стать онкогенами, называют протоонкогенами.
Онкосупрессоры — это гены, которые кодируют белки, подавляющие опухолевые свойства. Эти белки способны заблокировать клеточный цикл в случае наличия неисправимых повреждений ДНК и запустить программу гибели клеток.
Когда мутация случается в протоонкогене и одновременно в гене-супрессоре опухолей, то вероятность того, что клетка станет злокачественной, кратно возрастает.
Это можно объяснить с помощью аналогии с автомобилем: представьте, что движение машины — это клеточное деление. Онкогены — это педаль газа, которую заклинило из-за поломки (мутации), поэтому машина несется вперед независимо от того, нажимают на педаль или нет. При этом у машины есть тормоза, которые пытаются работать, но из-за большой нагрузки со временем сгорают, — это онкосупрессоры. Если поломка случилась и с педалью газа, и с тормозами, то машине не избежать аварии.
Классические ключевые признаки раковой клетки
В 2000 году биологи Роберт Вайнберг и Дуглас Ханахан опубликовали статью «The Hallmarks of Cancer» в журнале Cell, в которой перечислили ключевые признаки раковых клеток.
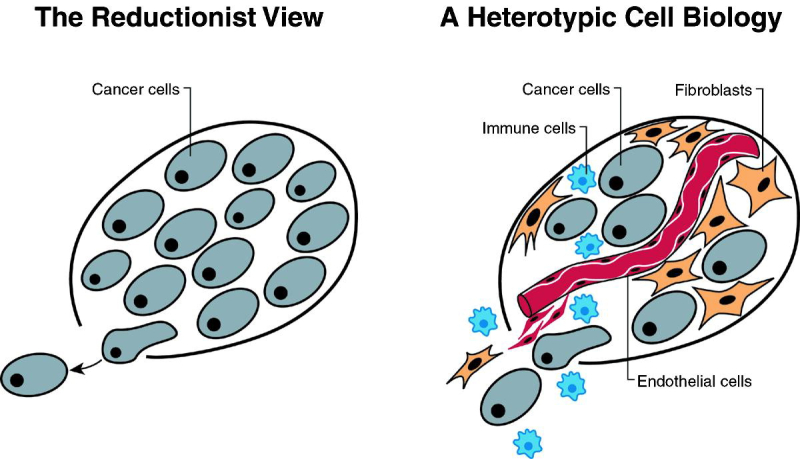
Иллюстрация из статьи биологов Роберта Вайнберга и Дугласа Ханахана в журнале Cell. Здесь они предлагают рассматривать опухоли как сложные ткани, в которых мутировавшие раковые клетки мобилизовали и подорвали жизнедеятельность нормальных типов клеток. Источник: www.cell.com
Сами снабжают себя сигналами, чтобы расти и делиться. Обычно здоровые клетки размножаются только при наличии факторов роста — определенных стимулирующих сигналов извне. Такими сигналами могут выступать молекулы или гормоны, которые активируют рецепторы клетки, чтобы запустить или подавить работу какого-либо гена. Раковые клетки не нуждаются в таких сигналах извне и могут добывать их самостоятельно.
Например, они могут делать это с помощью аутокринной регуляции ― этот процесс означает, что раковые клетки сами производят гормоны и другие химические вещества, чтобы начать делиться и расти. Другой способ — паракринная регуляция, при которой раковая клетка синтезирует факторы роста с помощью соседних клеток, изменяя их поведение. Также раковые клетки способны воздействовать на сигнальные белки. Например, модифицировать их таким образом, чтобы они не нуждались в активации рецепторов и были активны по умолчанию. Тогда сигнальные белки будут передавать сигналы о делении клетке, и та будет делиться независимо от окружающей среды и наличия в ней факторов роста.
При этом у каждого вида рака свой, индивидуальный набор механизмов работы клеток, который зависит от мутаций.
Игнорируют сигналы от окружения, которые затормозили бы их деление. Если ДНК клетки сильно повреждена, в работу включаются белки-супрессоры, которые способны воспринимать внешние и внутренние сигналы о том, что что-то идет не так. Распространенный пример такого белка — p53. Именно этот белок чаще всего мутирует при разных видах рака и считается ключевым сенсором повреждения клеточной ДНК, в том числе и при развитии онкологических заболеваний. Если он обнаружит, что ДНК клетки разорвана, то передаст последней сигнал о том, что нужно остановить клеточный цикл. Это не позволит клетке делиться. В противном случае клетка вступит в деление с нарушенной структурой ДНК, что чревато появлением мутаций.
Чтобы выжить, раковая клетка воздействует на белки-супрессоры: заставляет их мутировать или сокращает их количество. Это позволяет раковой клетке игнорировать сигналы, которые должны остановить ее размножение.
Не хотят умирать. Раковая клетка сопротивляется апоптозу — программируемой клеточной гибели. Обычно клетки, у которых есть структурные и функциональные нарушения ДНК, умирают — в частности за счет белка p53, который посылает соответствующие сигналы клеткам. Но раковая клетка может сломать этот механизм, заставляя белок p53 мутировать и приобретать онкогенные функции.
Репликативное бессмертие. У эукариотических клеток существует предел того, сколько раз они могут поделиться — в среднем он составляет 50–70 раз. При каждом делении клетки ее хромосома укорачивается в концевых участках — теломерах, своего рода «защитных колпачках» хромосом. Теломеры не дают хромосоме повредиться и «склеиться» с другими хромосомами. С каждым делением клетки теломеры укорачиваются, а после определенного числа исчезают совсем — тогда клетка запускает программу самоуничтожения.
Раковые клетки компенсируют укорачивание теломер с помощью теломеразы — специального фермента, который удлиняет концевые участки хромосом и по сути делает клетку бессмертной. Теломераза почти не активна в здоровых соматических клетках, но вырабатывается в раковых клетках, которые уже прошли определенный путь деления. За счет этого раковые клетки имеют неограниченный репликативный потенциал, то есть могут делиться бесконечно.
3D-визуализация хромосомы с теломерами на концах. Источник: Axel Kock / photogenica.ru
Формируют вокруг себя новые кровеносные сосуды. Ангиогенез — процесс образования новых кровеносных сосудов в органе или ткани. Кровеносные сосуды имеют сложное строение, поэтому для их строительства клетке нужны ресурсы и определенный порядок действий. Обычно клетки запускают ангиогенез, когда получают сигналы из межклеточного пространства о том, что сосуды нужны. Например, это происходит во время развития эмбрионов, при заживлении ран и в течение менструального цикла.
Раковые клетки умеют взламывать эти сигналы, инициируя создание новых кровеносных сосудов в местах своего скопления. Это позволяет клеткам обеспечить постоянный приток кислорода и других питательных веществ к растущей опухоли.
Метастазирование. Раковые клетки способны отрываться от места своего происхождения и проникать в соседние ткани. За счет этого свойства опухоль может распространяться по всему организму. Для этого клетки должны проникнуть в соседние ткани, претерпеть эпителиально-мезенхимальный переход (в частности, утратить связи с другими клетками эпителиального слоя и базальной мембраной, изменить форму и так далее), проникнуть в окружающие ткани через базальную мембрану, а затем попасть в кровеносные сосуды, внедриться через них в другие органы и начать делиться. В этом процессе большая часть клеток погибает, а проходят отбор и выживают наиболее злокачественные.
Позже список ключевых признаков рака был дополнен.
Как с этими суперспособностями раковых клеток уже может бороться наука
Традиционные способы лечения рака основаны на хирургических методах, а также на химиотерапии и радиотерапии. Последние способы нацелены на то, чтобы повреждать ДНК часто делящихся клеток различными химическими и физическими агентами. Однако при таком лечении могут страдать не только раковые, но и здоровые клетки — в частности, клетки эпителия и крови. Чтобы решить эту проблему, ученые разрабатывают новые способы лечения, направленные на конкретные свойства опухолевых клеток.
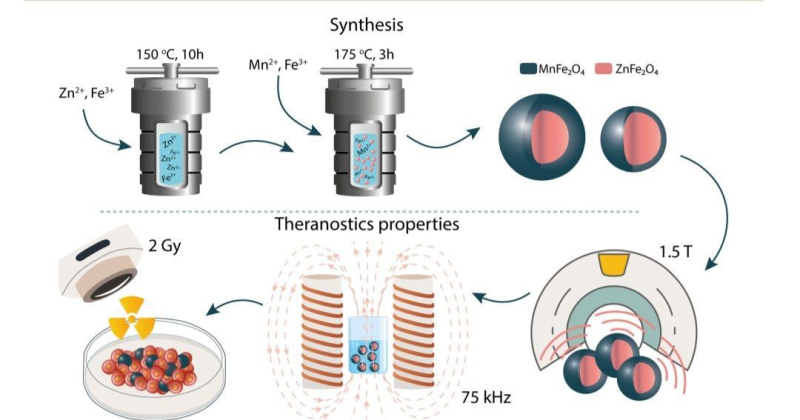
Новый подход к диагностике и терапии рака с использованием наночастиц, предложенный учеными ИТМО. На изображении представлены основные этапы разработки композитных наночастиц. На первом этапе с помощью двухстадийного гидротермального синтеза были получены магнитные наночастицы со структурой ядро-оболочка. На втором их проанализировали на способность проявлять контрастные свойства, разогреваться во внешнем магнитном поле и усиливать ренгеновское излучение для последовательной диагностики и терапии. Источник: pubs.rsc.org
Остановить бесконтрольное деление. Один из «пусковых механизмов» рака молочной железы и желудка — рецептор HER-2. Активация этого рецептора запускает размножение клетки и делает ее более злокачественной. Чтобы заблокировать этот рецептор и остановить деление раковых клеток, ученые используют таргетные препараты — например, трастузумаб. Он основан на специальных белках, которые связываются с рецептором HER-2 и не дают ему взаимодействовать с фактором роста, подавляя чрезмерные сигналы к делению клеток.
Вернуть контроль над клеточным циклом. Чтобы клетка не делилась бесконечно и вовремя умирала, ученые используют ингибиторы циклин-зависимых киназ. Это белки, которые подавляют производство ферментов, участвующих в регуляции клеточного цикла. Например, для лечения рака молочной железы используют ингибитор, подавляющий CDK 4/6 — вещество, которое инициирует рост и репликацию клеток при раке. Данные доклинических исследований показали, что двойное ингибирование CDK 4/6 и сигнального пути ER блокирует рост клеток при раке молочной железы в первой фазе клеточного цикла.
Прочитайте также:
Ученые ИТМО предложили новый подход к диагностике и терапии рака с использованием наночастиц
Усилить апоптоз. Также существуют препараты, которые подавляют белки, препятствующие гибели раковых клеток — миметики проапоптотических белков. Например, ученые разработали молекулы, которые имитируют поведение белка BH3. Этот белок, в свою очередь, воздействует на другой белок, BCL2, который тормозит гибель раковых клеток. В результате BH3-миметик уничтожает злокачественные клетки. Препарат этого класса используют для лечения хронического лимфоцитарного лейкоза и острого миелоидного лейкоза.
Подавить ангиогенез. Один из способов лечения рака направлен на то, чтобы остановить ангиогенез — процесс образования новых кровеносных сосудов в органе или ткани, который инициируют раковые клетки для своего питания. Для ангиогенеза требуется стимул в виде сигнального белка VEGF, который вырабатывают раковые клетки, чтобы инициировать рост сосудов. Подавить активность этого белка можно несколькими способами.
-
Воздействовать либо на сам белок VEGF, либо на его рецептор другим белком так, чтобы белок VEGF и его рецептор больше не смогли связаться друг с другом, а следовательно, и посылать сигналы для ангиогенеза. В частности для этого используют нейтрализующие моноклональные антитела — препараты, которые с избирательно блокируют молекулярные мишени, провоцирующие опухолевый процесс.
-
Синтезировать белки, которые будут похожи на рецепторы белка VEGF — с их помощью можно связать часть имеющегося в межклеточном пространстве белка VEGF. Тогда меньше молекул VEGF дойдет до своих настоящих рецепторов, и, следовательно, сигнал к созданию сосудов будет более слабый.
Материал подготовлен по мотивам лекции Евгении Платоновой «Как клетка становится опухолевой», которая состоялась в марте в библиотеке «Планетарий 1».




